前言
近日,国家市场监管总局、国家标准委发布了医疗器械行业质量管理体系和风险管理两大体系标准升级的公告,进一步显示了国家对于咱们医疗器械行业的重视。
1.《医疗器械风险管理对医疗器械的应用》:当前对标ISO14971-2007版的YY/T0316-2016升级为GB/T42062-2022(采标ISO14971-2019)。
2.《医疗器械质量管理体系用于法规的要求》:当前对标ISO13485-2016版的YY/T0287-2017升级为GB/T42061-2022。
今天,小编就带大家捋一捋行业相关的国标和行标信息,希望能对各位战友的工作带来些许便利。
法规对标准的要求
《体外诊断试剂注册与备案管理办法》对于标准有很明确的要求,简单摘录如下:
第六条国家药品监督管理局医疗器械标准管理中心,依职责承担实施体外诊断试剂监督管理所需的体外诊断试剂标准管理相关工作。”【明确管理部门】
第十四条体外诊断试剂注册、备案,应当遵守相关法律、法规、规章、强制性标准,……,保证信息真实、准确、完整和可追溯。
第二十条体外诊断试剂应当符合适用的强制性标准。产品结构特征、技术原理、预期用途、使用方式等与强制性标准的适用范围不一致的,申请人、备案人应当提出不适用强制性标准的说明,并提供相关资料。
没有强制性标准的,鼓励申请人、备案人采用推荐性标准。
第二十六条从事体外诊断试剂产品研制实验活动,应当符合我国相关法律、法规和强制性标准等的要求。
第八十三条有下列情形之一的,不予延续注册:
……
(二)新的体外诊断试剂强制性标准或者国家标准品发布实施,申请延续注册的体外诊断试剂不能达到新要求;
标准的查询途径
前面已经明确了,国家药品监督管理局医疗器械标准管理中心负责标准管理,所以查询的最直接途径就是去标管中心。
如下图所示,红框的三个入口就可以查询相关的国标和行标。

我们先进去看一下,排在最前面的就是刚才要提升为国标的两个行业重要标准
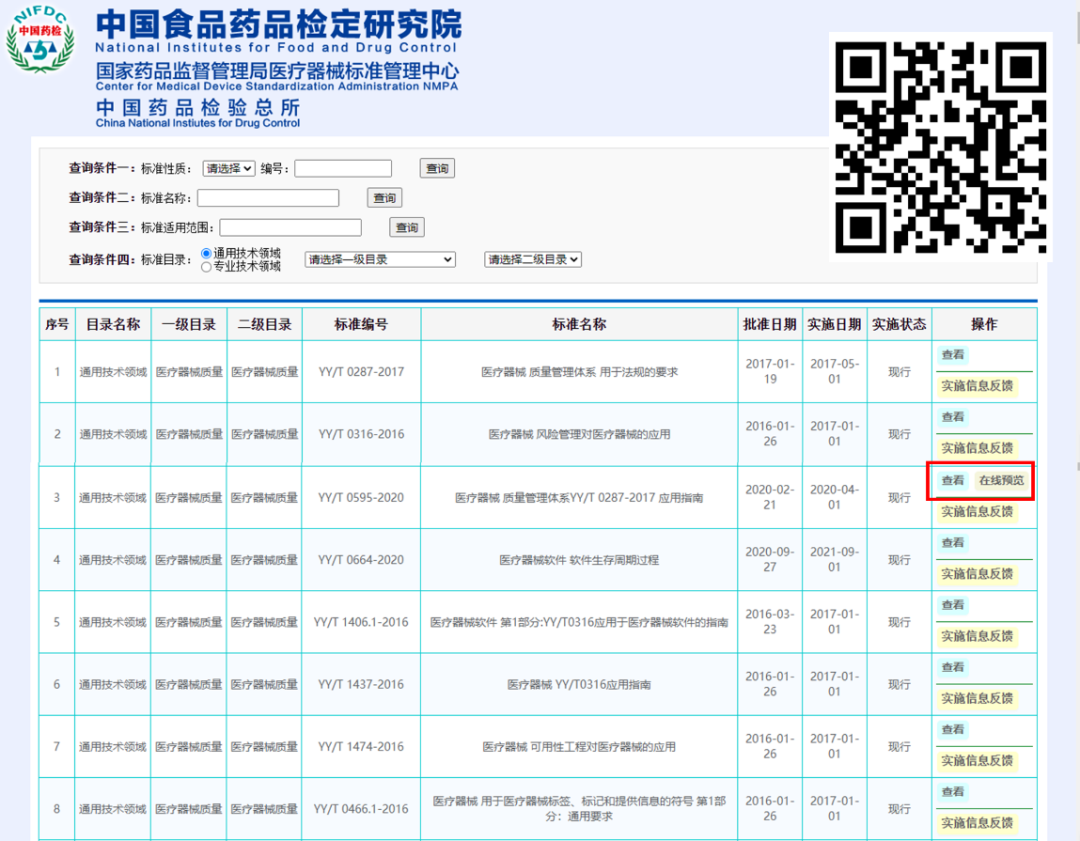
运气好的话,标准是可以在线预览的。
同时针对国标还可以在国家标准全文公开系统查看
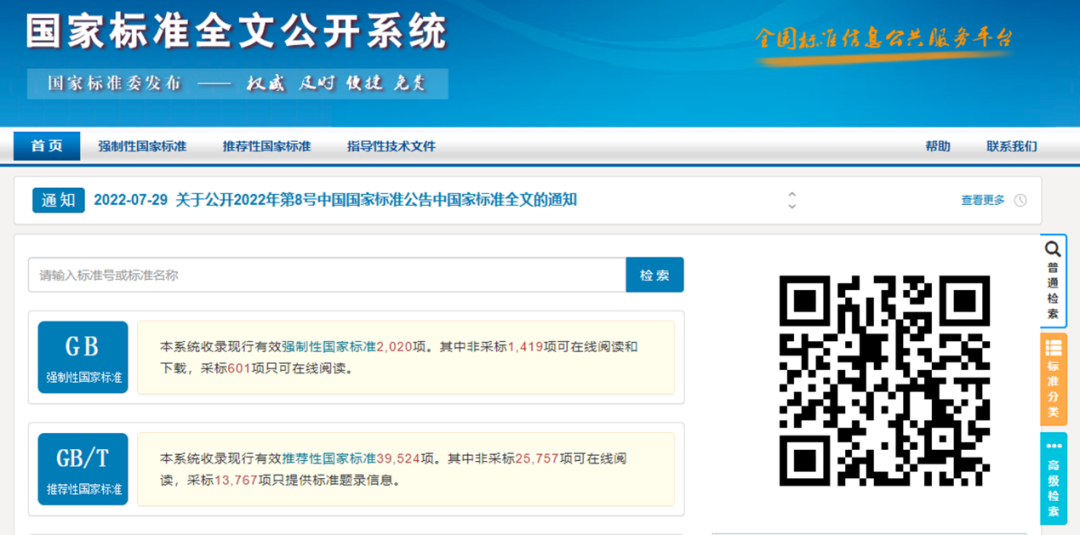
但是如果是等同转化国际标准的,由于版权的原因是无法直接在线看的。
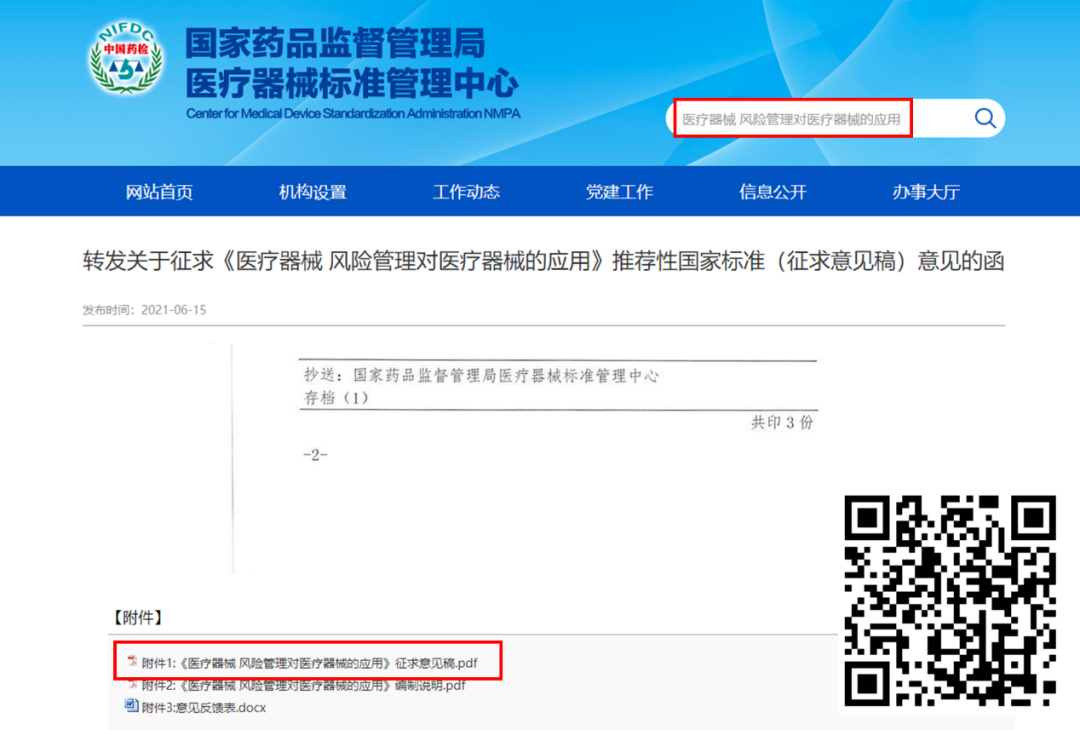
那这种情况怎么办呢?小编分享一个小妙招——征求意见稿。因为所有的标准正式发布之前都会有征求意见的流程,这个时候的标准可能跟最终标准有个别调整,但是也差别不会太大了。还可以把PDF版本放在自己的文件夹,是不是很有安全感!
举个例子,前面提到即将升级为国标的《医疗器械风险管理对医疗器械的应用》,搜索一下就可以找到
行业相关标准汇总
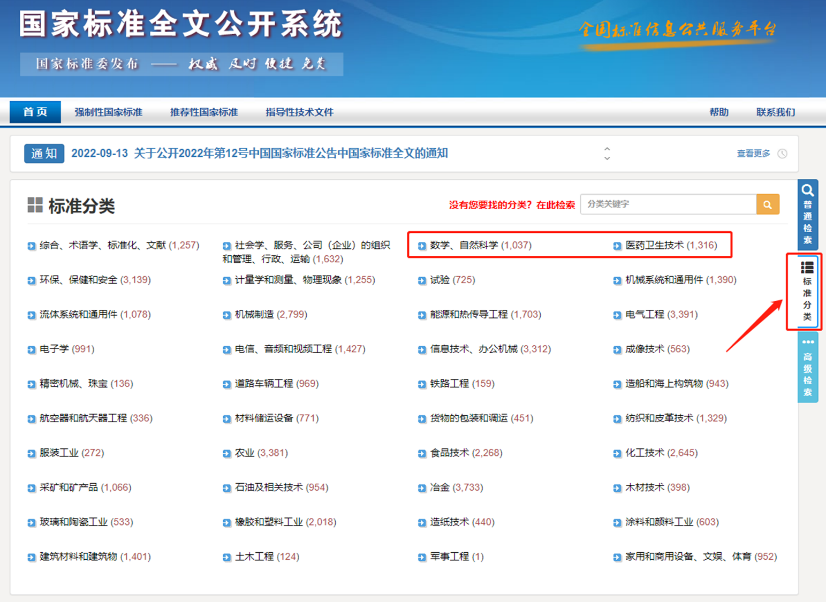
进一步的,为了方便大家检索和筛选,小编收集了医疗器械和IVD相关行标和国标目录,大概途径如下:
(1)国标中自然科学和医药卫生技术相关标准
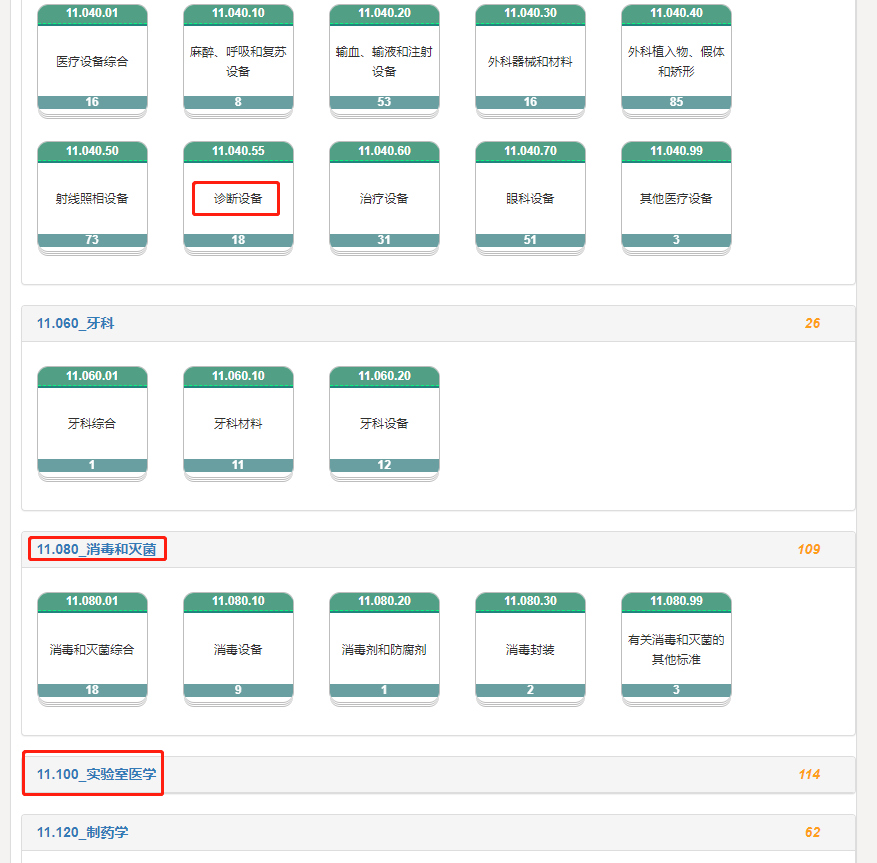
(2)行标中通用领域和专业领域相关标准
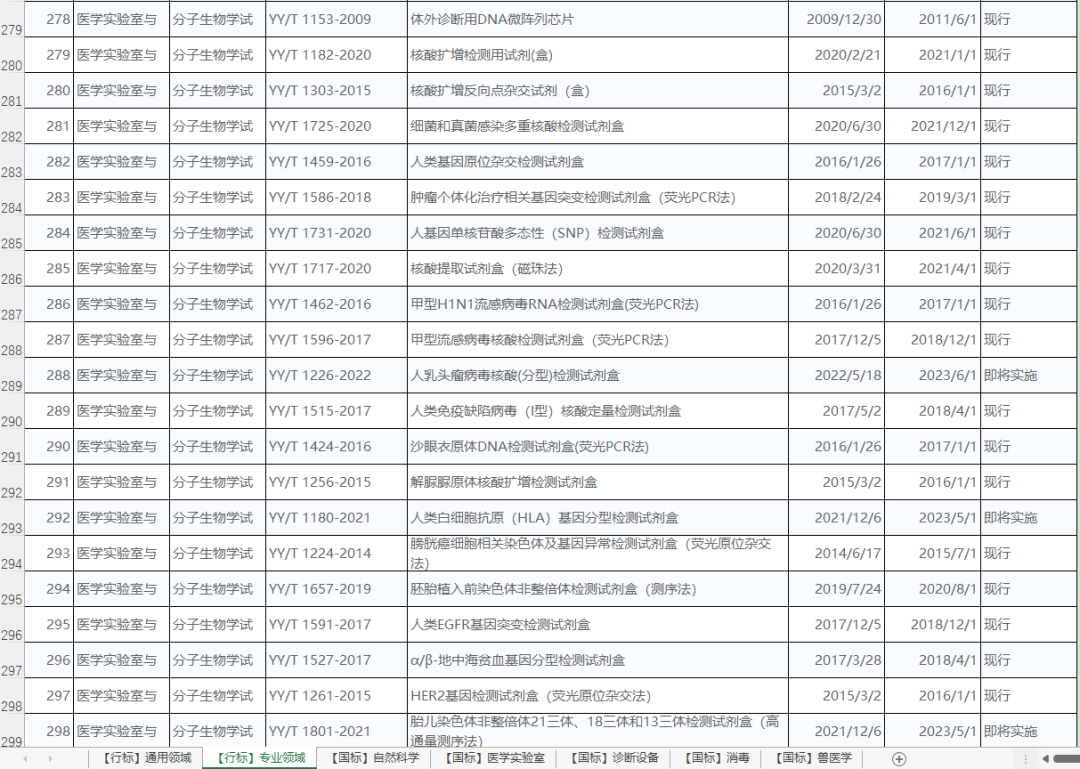
包括免疫、生化、微生物、分子等等各个领域的标准,下图为部分分子相关行标的截图
以上便是对于标准相关的法规、查询方法和工具包的简介,限于篇幅和实际使用的方便,工具包请自行下载。















